Daniella Dwir
Je suis cheffe de projet au sein de l'unité de recherche sur la psychose du Centre de neurosciences psychiatriques.
Le but de ma recherche est d’investiguer les mécanismes d’interaction entre le stress oxydatif et la neuroinflammation, et l’effet sur la connectivité locale entre un certain type de neurones inhibiteurs (exprimant la parvalbumine) et les neurones excitateurs. De nombreuses études ont montré des altérations de la connectivité locale concernant les synapses glutamatergiques et GABAergiques, ainsi que les dendrites neuronales et les épines dendritiques chez les patients atteints de schizophrénie. Notamment, les altérations des interneurones à parvalbumine (PVI) sont une caractéristique de la maladie, conduisant à un déséquilibre excitateur/inhibiteur (E/I), observé chez les patients atteints de schizophrénie. De plus, des études post-mortem ont révélé une diminution des épines dendritiques dans certaines régions du cerveau, comme le cortex préfrontal dorsolatéral, le cortex temporal et l'hippocampe des patients. La schizophrénie étant considéré comme une maladie du développement, il a été proposé que ces altérations des épines dendritiques et des PVI puissent survenir au cours de la maturation du cerveau, durant la gestation et le développement postnatal (enfance et adolescence).
Ma recherche se concentre sur les interactions entre des facteurs de risque génétique et environnementaux qui peuvent mener au stress oxydatif et à la neuroinflammation, durant la période sensible du développement cérébral.
Ces recherches sont menées à différents niveaux, du modèle cellulaire avec les cellules souches pluripotentes induites (iPSC), aux modèles animaux, et aux cohortes de patients (sang, imagerie, clinique).
Axes de recherches
Implication de MMP9/RAGE dans la maturation des PVI
J'ai étudié les mécanismes précis qui régissent les interactions réciproques entre le stress oxydatif et l'inflammation, en particulier pendant les étapes clés du développement, et leur effet à long terme sur la maturation des PVI, dont le déficit est une caractéristique de la schizophrénie. Mes recherches mettent en évidence un cercle vicieux (Figure 1) impliquant MMP9/RAGE qui perpétue une augmentation du stress oxydatif et de la neuroinflammation durant les phases de développement postnatal du cerveau, affectant la maturation des PVI (Dwir et al., Mol Psy 2019;Dwir et al., SZ Bulletin 2021). Ces altérations des PVI peuvent être récupéré en bloquant MMP9/RAGE, soit par un inhibiteur spécifique, soit par une supplémentation en antioxydant et un environnement enrichi. De plus, en collaboration avec la société pharmaceutique Boehringer Ingelheim, j'ai pu identifier une période précise et propice à une intervention sur le mécanisme de MMP9/RAGE, ce qui a conduit à la récupération des PVI, avec un effet à long terme jusqu’à l’âge l’adulte (Dwir et al., European Neuropsychopharmacology 2021).
J'étudie actuellement le mécanisme MMP9/RAGE dans d'autres modèles animaux pertinents pour la schizophrénie, tels que FMR1 KO, les souris MAM et un modèle de restriction de croissance intra-utérine (Allgauer et al., Transl Psy 2023) afin d'étendre la pertinence de ce mécanisme.
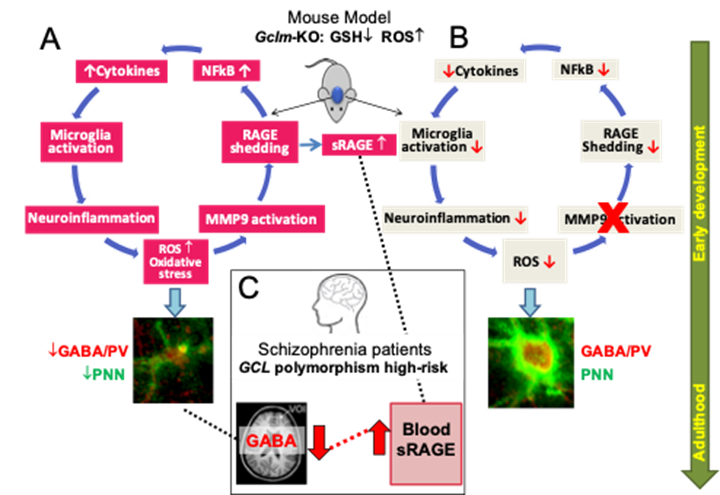
Figure 1: cercle vicieux de stress oxydatif et de neuroinflammation médié par le mécanisme MMP9/RAGE dans le modèle animal et chez les patients dans la phase précoce de psychose
Le mécanisme de MMP9/RAGE s'est avéré pertinent pour la schizophrénie, car les niveaux de RAGE mesurés dans le sang des patients dans la phase précoce de psychose étaient augmentés et étaient associés à un niveau diminué de GABA dans le cortex préfrontal. Ces anomalies ont pu être amélioré par une supplémentation d’un antioxydant pendant 6 mois (Dwir et al., Mol Psy 2019;Dwir et al., SZ Bulletin 2021). De plus, l’activité de MMP9 mesuré dans le sang des patients dans la phase précoce de psychose était associée à une mesure d’imagerie cérébrale par résonance magnétique pouvant potentiellement refléter la neuroinflammation dans l'hippocampe (Seitz-Holland et al., under revision).
Dans l'ensemble, mes recherches translationnelles suggèrent que MMP9/RAGE sont des biomarqueurs prometteurs pour la détection précoce et la stratification des patients à risque de psychose. Ce mécanisme est prometteur en tant que cible pour de nouvelles approches thérapeutiques en psychiatrie.
Interaction gène-environnement conduisant à une dérégulation redox et la neuroinflammation
L'interaction gène-environnement et son rôle sur la dérégulation redox dans la schizophrénie ont été étudiés plus en détail en utilisant des cellules souches pluripotentes induites (iPSC). J'ai participé à la mise en place de la technologie iPSC par Basilio Giangreco, à partir de fibroblastes de patients dans la phase précoce de psychose et de contrôles sains. Ces iPSC sont ensuite induit en progéniteurs neuronaux et en neurones pour étudier le rôle de l'interaction gène-environnement durant leur différentiation et maturation. Ce modèle est prometteur pour une meilleure compréhension de l'interaction entre les risques génétiques et environnementaux au cours du développement précoce du cerveau, conduisant à la schizophrénie.
Principaux axes de recherche actuels
- Investiguer le mécanisme de MMP9/RAGE comme biomarqueur des altérations de connectivité locale chez les patients en phase précoce de la psychose et chez les individus à risque pour la psychose.
- Développement d’une nouvelle méthode de détection du mécanisme de MMP9/RAGE chez les patients.
- Identification des mécanismes, induits par des stimuli de stress, qui altèrent la maturation des neurones humains de patients, en utilisant les iPSC comme modèle.
Collaborations internationales
- 2022-présent: Investigation des marqueurs prénataux de dérégulation redox dans une large cohorte national et leur lien aux troubles psychiatriques du développement neurologique, en collaboration avec Prof Alan Brown (Columbia University Medical Center, New York, USA) et Prof Kim Do et financé par le National Institute of Mental Health, USA.
- 2019-2021: Intervention précoce dans la schizophrénie : Cibler les mécanismes contribuant au déséquilibre excitateur/inhibiteur induit par la dérégulation redox, en collaboration avec Prof Kim Do et financé par Boehringer Ingelheim (Biberach, Allemagne)
Bourses et prix
- 2014: Travel Grant from the Swiss Society for Neuroscience (SSN), Switzerland
- 2019: Swiss Society of Biological Psychiatry (SSBP) poster award, for the 4th congress of the Swiss Federation of Clinical Neuro-Societies (SFCNS), Lausanne (Switzerland); N-acetyl-cysteine treatment and environmental enrichment reversed the long-lasting effect of oxidative stress on PVI circuitry: relevance for schizophrenia
- 2021: Swiss Society of Biological Psychiatry (SSBP) Young Investigator Award, for the work: “Timely N-acetyl-cysteine and environmental enrichment rescue oxidative stress induced parvalbumin interneurons impairments via MMP9/RAGE pathway: a translational approach for early intervention in psychosis”
- 2022: Adrian & Simone Frutiger Fellowship from the Adrian & Simone Frutiger Foundation
Lien: ORCID
Lien: LinkedIn



