La science face au manque d’organes

Notre pays compte davantage de personnes en attente d’une greffe que d’organes disponibles. À Lausanne comme ailleurs, les spécialistes redoublent d’efforts pour tenter d’améliorer la situation.
En Suisse, 1415 personnes figuraient sur liste d’attente fin 2019 pour recevoir un ou plusieurs organes. 582 patients avaient bénéficié d’une greffe et 46 étaient décédés, faute d’avoir pu être transplantés à temps. Si l’un des défis majeurs consiste à augmenter le nombre de donneurs, il n’est pas le seul.
Qui dit greffe dit rejet
« L’un des principaux obstacles est, depuis toujours, le problème du rejet : une réponse immunitaire du receveur face à un organe génétiquement incompatible », explique Déla Golshayan, professeure à la Faculté de biologie et de médecine (FBM) de l’UNIL, médecin cadre au Centre de transplantation d’organes (CTO) et responsable du Laboratoire d’immunopathologie de transplantation au CHUV.
Le système immunitaire permet de différencier le « soi » du « non-soi » et assure ainsi la défense de l’organisme en s’attaquant aux pathogènes externes comme les virus, bactéries ou parasites. Problème : il considère aussi un greffon comme un corps étranger et tente à tout prix de s’en débarrasser.
Chez l’être humain, les antigènes des leucocytes humains (abrégés HLA, pour human leukocyte antigen) jouent un rôle crucial lors du phénomène de rejet. Lorsqu’une personne est transplantée, ses lymphocytes T détectent les molécules HLA du greffon (« non-soi ») et montent une défense immunitaire. Ils migrent dans le nouvel organe puis produisent des cytokines, qui créent une inflammation locale. Parallèlement, d’autres lymphocytes, les lymphocytes B, s’activent pour fabriquer des anticorps dirigés contre le greffon. Si cette réaction inflammatoire n’est pas traitée, l’organe finit par se nécroser et devenir dysfonctionnel.

Un principe également valable lors d’allogreffes de tissus tels que des valves cardiaques ou des vaisseaux sanguins.« Pour maximiser les chances de réussite, nous veillons à ce que donneurs et receveurs possèdent le même groupe sanguin et que la compatibilité entre leurs HLA soit la meilleure possible », souligne Déla Golshayan. De plus, les personnes greffées prennent, à vie, un traitement antirejet. L’histoire de la transplantation est intimement liée au développement de ces médicaments et, plus généralement, à une meilleure compréhension des mécanismes immunitaires.
La transplantation, toute une histoire
Durant la première partie du XXe siècle, même lorsque les opérations étaient techniquement réussies, les patients rejetaient les organes et décédaient. « Le premier vrai succès date de 1954 : une greffe de rein entre jumeaux monozygotes, génétiquement identiques, ce qui a permis de contourner le problème du rejet », relate Manuel Pascual, professeur à la FBM, directeur du CTO et du Centre universitaire romand de transplantation.
Mais la véritable révolution intervient dans les années 80, avec la mise sur le marché de la ciclosporine, un médicament développé par la firme pharmaceutique suisse Sandoz.Depuis, plusieurs générations de traitements se succèdent et, actuellement, la survie des greffons et des receveurs est globalement bonne à moyen terme. En clair, on ne meurt plus du rejet, on le traite.

« Un an après une transplantation de rein ou de pancréas, le taux de rejet s’élève à environ 10-20%. Légèrement moins bien que le foie (5-10%), mais mieux que le cœur et les poumons (40-50%) », détaille Manuel Pascual. La durée de vie des greffons varie aussi d’un organe à l’autre : rein et foie peuvent fonctionner 25 à 40 ans, cœur et poumon dépassent rarement les 20 à 25 ans. « Avec les poumons, qui agissent comme un filtre face à l’environnement extérieur, le risque d’infection et de rejet est plus important. Mais une seconde greffe, voire plus, s’avère souvent possible pour tous les organes. »
Rééduquer le système immunitaire
Les médicaments antirejet sont appelés « immunosuppresseurs » ; ils baissent l’ensemble des défenses immunitaires du receveur pour lui permettre de tolérer l’organe greffé. Revers de la médaille, ils le rendent aussi davantage vulnérable face aux bactéries et virus, y compris certaines infections et cancers qui en découlent. « L’idéal serait d’affaiblir le système immunitaire du patient de manière ciblée afin qu’il tolère le greffon tout en restant efficace contre les autres pathogènes », explique Déla Golshayan .
Selon elle, une des solutions est à chercher du côté de la thérapie cellulaire. Notre système immunitaire possède des mécanismes de régulation qui empêchent une réponse disproportionnée contre les pathogènes externes, réponse qui pourrait être délétère. L’équilibre se crée par le biais de cellules spécialisées, en particulier les lymphocytes T régulateurs, qui pourraient être utilisées en transplantation pour contrôler la réaction de l’organisme contre le greffon et prévenir les rejets.
« L’idée consiste à mettre en contact, en laboratoire, des molécules HLA du donneur et des lymphocytes T régulateurs du receveur. En manipulant ces lymphocytes, nous pouvons les éduquer afin qu’ils régulent l’activation immunitaire seulement en réponse aux HLA du donneur et sans interférer avec les défenses habituelles de l’hôte. Ils peuvent ensuite être transfusés au patient qui, au moment de recevoir l’organe, est prêt à le tolérer. »
Une autre option fait appel à des techniques d’ingénierie. Les scientifiques peuvent modifier les récepteurs situés sur les lymphocytes T régulateurs afin de leur faire reconnaître les HLA du donneur de manière très spécifique et d’induire une tolérance face au greffon.Grâce à ce type de travaux, Déla Golshayan a rendu des souris tolérantes à une transplantation de peau, à vie. « Les premiers essais menés sur l’être humain, par d’autres chercheurs, se révèlent prometteurs. Les patients acceptent les organes, avec un minimum d’immunosuppresseurs », indique la spécialiste, qui a également identifié des médicaments antirejet qui pourraient maximiser l’effet des lymphocytes T régulateurs.
La tolérance s’apprend
Une autre stratégie consiste à induire une tolérance dite « centrale », via le thymus. « Les lymphocytes T sont sélectionnés dans cet organe en fonction de leur réactivité face à des antigènes issus du "soi ". Toute cellule T qui s’active est potentiellement dangereuse et sera donc éliminée. Ce mécanisme permet d’éviter les maladies auto-immunes », illustre Déla Golshayan.
Des chercheurs ont tiré profit de ce principe immunologique naturellement présent. Ils perfusent à un patient en attente d’un rein des cellules de moelle osseuse de son futur donneur, vivant. Les lymphocytes T du receveur qui détectent ces nouveaux HLA (« non-soi ») sont progressivement éliminés dans le thymus. Ceci permet, dans un deuxième temps, une greffe à partir du même donneur, sans risque de rejet. « Une trentaine de personnes ont reçu ce traitement expérimental, principalement à Boston mais aussi à Zurich (deux cas), et ont pu être sevrées des médicaments immunosuppresseurs . »
« D’autres scientifiques misent sur le potentiel des cellules souches, capables de se transformer en n’importe quelle cellule et d’en reproduire les fonctions, poursuit Déla Golshayan. Ils ont ensemencé des matrices de collagène (« squelette » en trois dimensions de l’organe que l’on veut recréer) avec des cellules souches animales ou humaines. Celles-ci se différencient en fonction de l’environnement imposé expérimentalement. Testé chez le rat, ce système remarquable a vu naître, en quelques semaines, un cœur qui battait. »
Même si ces protocoles se révèlent prometteurs et extrêmement intéressants du point de vue scientifique, nos protagonistes les nuancent. En particulier au regard du coût-bénéfice pour le patient. « Les médicaments actuels possèdent certes des effets secondaires mais se prennent par voie orale, simplement », souligne Manuel Pascual. « Les alternatives nécessitent de plus lourdes infrastructures et un suivi minutieux des patients, qui seraient ainsi davantage dépendants des hôpitaux », complète Déla Golshayan.
Avec l’aide des cochons
Et si la solution venait des animaux ? La piste de la xénogreffe est explorée depuis des décennies. « Il existe actuellement des porcs dont les cellules ont été génétiquement modifiées afin qu’elles n’expriment pas certains HLA humains, leurs organes ne seraient donc pas reconnus comme étrangers par le système immunitaire de l’homme », note Manuel Pascual.
Autre possibilité : introduire des gènes humains chez l’animal, qui grandirait ainsi avec un rein ou un cœur qui ne serait pas rejeté par le receveur. Ces recherches restent expérimentales, de nombreuses barrières immunologiques, physiologiques et infectieuses devant encore être levées. Elles se heurtent aussi à des questions éthiques et psychologiques. « Il y a encore 20 ans, la xénogreffe était perçue comme la meilleure source potentielle d’organes, poursuit le professeur. Mais les choses ont évolué. Il se pourrait que la technologie soit prête d’ici cinq à dix ans mais qu’elle ne soit plus admise d’un point de vue sociétal. »
Les organes de demain, des machines ?
« Dès les années 30, des chercheurs ont imaginé remplacer le cœur par une machine », relate Piergiorgio Tozzi, professeur à la FBM et médecin cadre au Service de chirurgie cardiaque du CHUV. Même si, près d’un siècle plus tard, aucun cœur artificiel implantable n’est encore au point, des travaux récents laissent imaginer pouvoir glisser, un jour, de la fiction à la réalité.
Le chirurgien a inventé un dispositif d’un genre particulier. Baptisé Rolling Heart, il ne ressemble en rien à un cœur biologique – il s’agit d’une sphère en titane de la taille d’une balle de tennis – mais en endosse la fonction : pomper du sang. À l’intérieur, deux disques entrecroisés, qui bougent, divisent l’espace en quatre, comme dans un vrai cœur. À droite, deux chambres recueillent le sang et l’envoient vers les poumons. À gauche, les deux autres réceptionnent le liquide rechargé en oxygène et le redistribuent dans tout l’organisme. La fréquence à laquelle ce cœur artificiel doit « battre » est gérée par un ordinateur, à l’extérieur du corps.Le métal n’étant pas une matière organique, il ne suscite pas de réaction immunologique de la part du receveur.
Les défis se situent à d’autres niveaux : « Il s’agit, premièrement, d’éviter que le sang ne stagne et ne forme des caillots qui pourraient bloquer la machine ou, pire, partir dans la circulation sanguine, explique Piergiorgio Tozzi. Deuxièmement, il faut empêcher le traumatisme des globules rouges qui, lorsqu’ils traversent un matériau étranger, sont exposés à un stress et peuvent éclater. » Deux problèmes résolus en modifiant certains angles et formes à l’intérieur du Rolling Heart, dont le prototype est en cours de finalisation. Les études précliniques, menées sur des animaux, devraient débuter au CHUV d’ici fin 2021.
L’heure du choix
Piergiorgio Tozzi conçoit les organes artificiels comme un complément aux transplantations. « Mon rêve serait de pouvoir proposer aux patients plusieurs solutions, qui ne dépendraient pas obligatoirement du décès d’un autre être humain. »
À l’heure actuelle, même si la recherche progresse, les spécialistes s’accordent sur un point : rien ne remplace la greffe classique, et donc le don d’organes. Ainsi, à chacun de réfléchir à ce qu’il souhaite laisser, ou non, à autrui. Puis de le faire savoir.
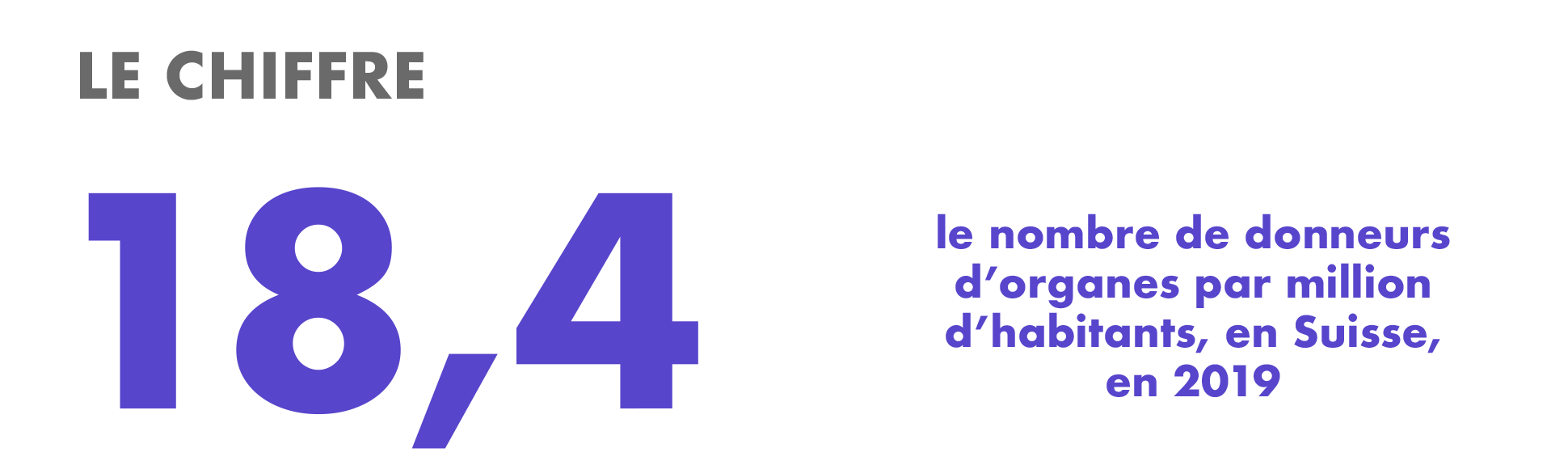
Ce chiffre augmente (12 en 2012), mais reste bas en comparaison avec nos voisins. En Espagne par exemple, championne du monde du don, il est de 48,9. Ceci s’explique entre autres par le fait que la majorité des pays européens connaissent le principe du consentement présumé. En Suisse, la situation pourrait bientôt évoluer dans ce sens
TRANSPLANTATION: LES CHIFFRES SUISSES EN 2019
En Suisse, les poumons, le cœur, le foie, les reins, l’intestin grêle et le pancréas sont greffés. Dans la mesure où des parties du foie sont capables de se régénérer et que nous pouvons vivre avec un seul rein, ces deux organes peuvent être donnés par des personnes vivantes. Tous les autres organes doivent être prélevés sur des individus décédés.
6 centres de transplantation et 5 réseaux hospitaliers de don
À chacun sa spécialité
Les deux centres de transplantation de Suisse romande, les hôpitaux universitaires de Lausanne (CHUV) et Genève (HUG), se sont réparti les greffes.
Au CHUV : greffes de poumon, cœur et rein
Aux HUG : greffes de foie, rein, intestin grêle et pancréas (y compris îlots de Langerhans)
Plus de la moitié des transplantations de poumon (56%) et de cœur (54%) réalisées en Suisse ont été effectuées au CHUV.
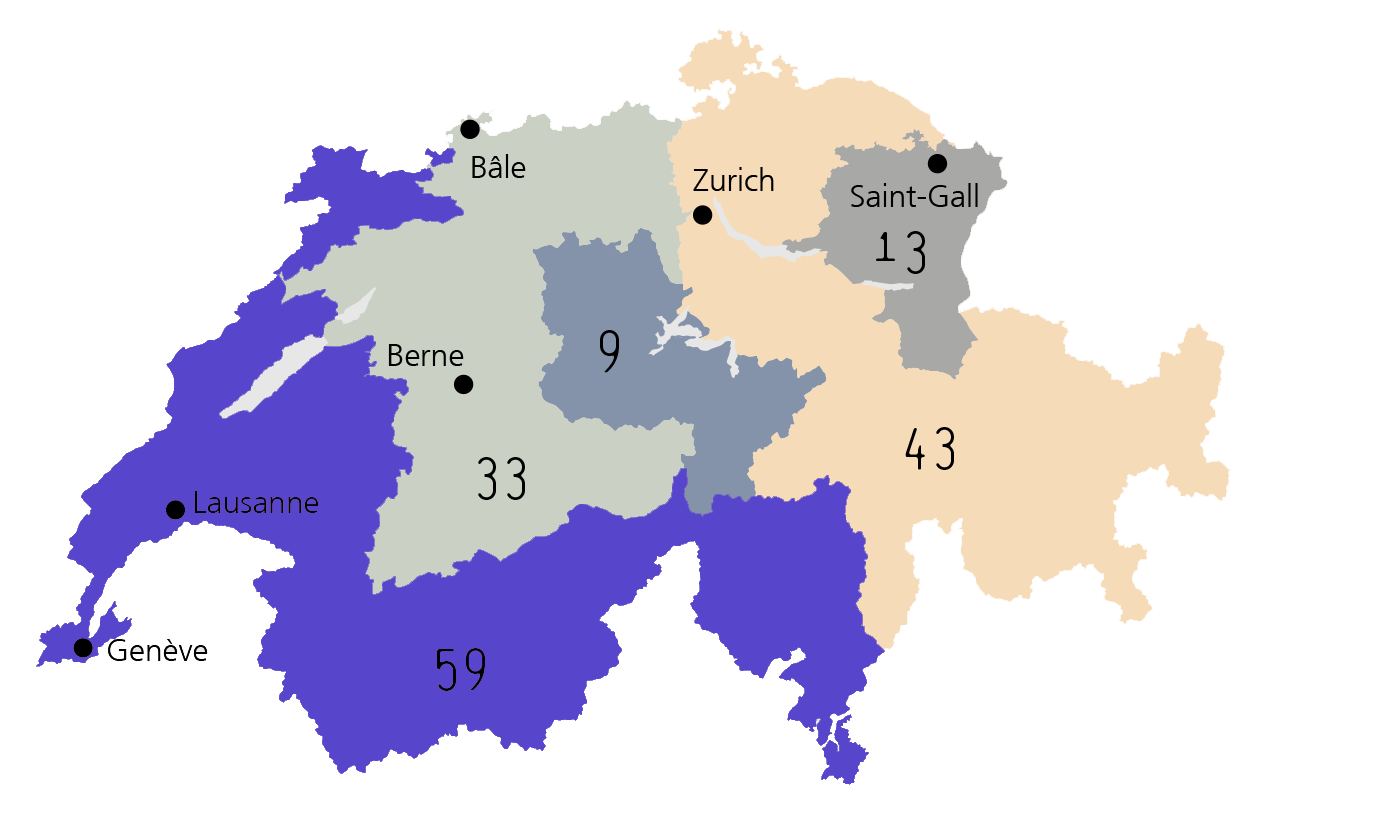
LES RECEVEURS D'ORGANES
La grande majorité des patients sur liste d’attente ont besoin d’un rein. C’est aussi l’organe le plus greffé.

Près de la moitié (49%) des personnes sur liste d’attente bénéficient d’un statut dit « inactif » : elles ne peuvent pas bénéficier d’une transplantation en raison de contre-indications temporaires : par exemple parce qu’elles ont contracté un virus ou qu’une opération est prévue.
Plus de 2,5 ans d’attente pour un rein

Temps d’attente médian, en jours :
• Rein : 930
• Pancréas, îlots : 539
• Poumon : 277
• Cœur : 213
• Foie : 169
Les greffes à l’ère du coronavirus (Covid-19)
Les transplantations dites « non vitales », comme celles de rein ou de pancréas, ont été mises en suspens pendant deux mois dans toute la Suisse. « Nous nous attendons, pour 2020, à une diminution d’environ 20 à 30% du nombre de greffes rénales et, par conséquent, à un allongement du temps d’attente. Les transplantations de cœur et de poumon n’ont jamais cessé et les greffes de foie n’ont été que légèrement affectées », note le Prof. Manuel Pascual, directeur médical du Centre universitaire romand de transplantation, qui regroupe le CHUV et les HUG.
LES DONNEURS D'ORGANES
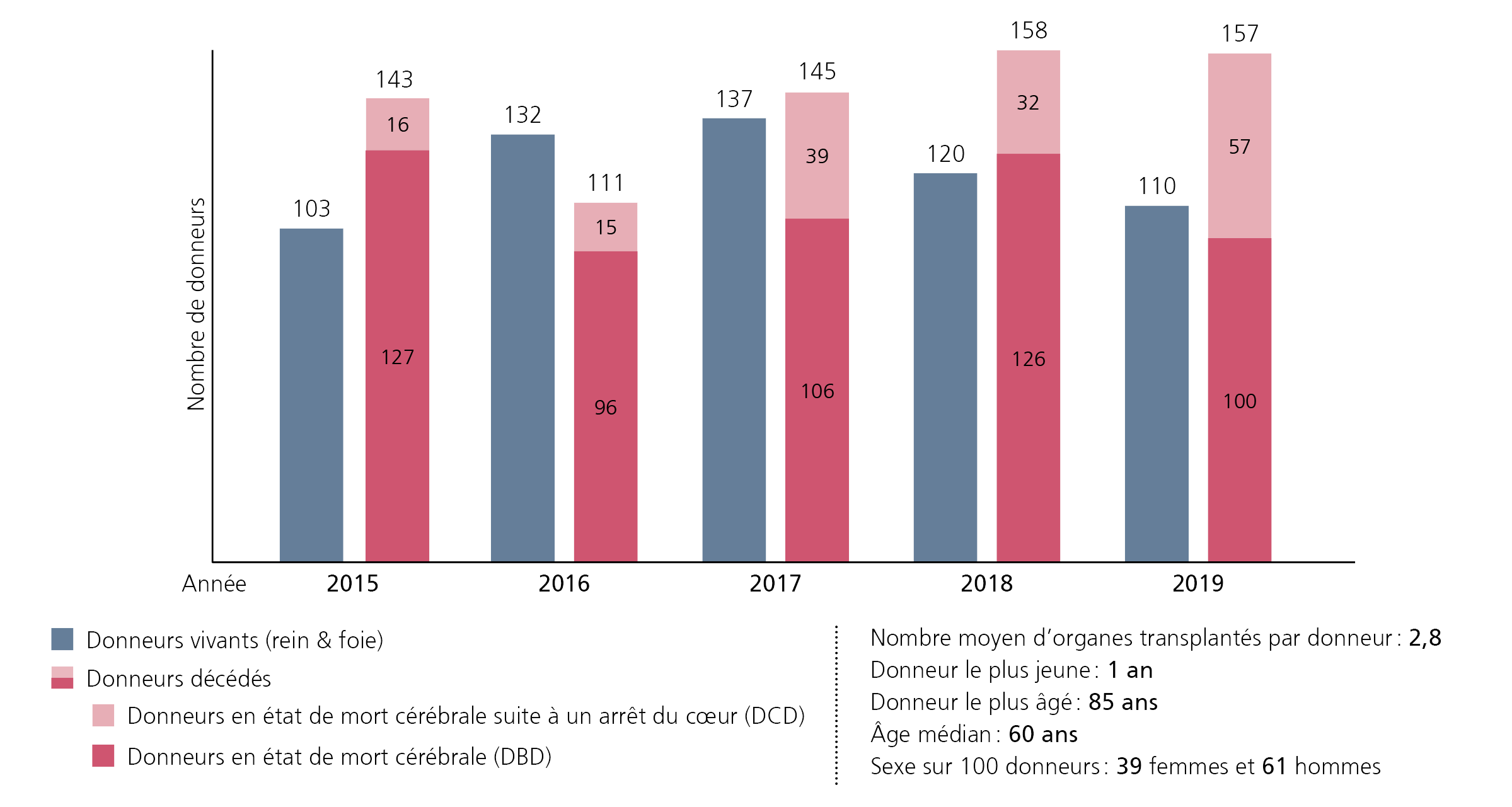
De nouveaux donneurs pour faire face au manque
Depuis les années 60, le concept de mort cérébrale s’est imposé : le décès d’une personne est établi quand toutes les fonctions de son cerveau se sont arrêtées de façon irréversible. C’est à ce moment-là, et en cas de consentement, que des organes peuvent être prélevés. Le plus souvent, les prélèvements sont effectués sur des individus qui sont décédés car leur cerveau était directement endommagé, suite à une hémorragie cérébrale ou un accident par exemple (scénario DBD, pour Donation after Brain Death).
Depuis 2016, le CHUV a implanté le programme « Donneur décédé après arrêt cardio-circulatoire ». « Nous réalisons désormais aussi des prélèvements sur des donneurs dont la mort cérébrale survient après l’arrêt du cœur, explique le Dr Marco Rusca, responsable du don d’organes au Service de médecine intensive adulte du CHUV. Ce cas de figure se présente chez les patients dont le pronostic est sans issue et pour lesquels nous décidons d’interrompre les traitements. » Le système cardiovasculaire cesse alors de fonctionner. Le cerveau n’est plus irrigué et le décès survient. Ce scénario est appelé DCD, pour Donation after Circulatory determination of Death.
UN ORGANE SUR DIX VIENT DE L'ETRANGER (EUROPE)
61 organes importés*
• 33 foies
• 9 cœurs
• 8 poumons
• 7 reins
• 4 pancréas / îlots
6 organes exportés
• 2 foies
• 2 reins
• 1 cœur
• 1 poumon
*Ce chiffre a plus que doublé en cinq ans. « Les organes sont importés pour des situations urgentes. L’augmentation de celles-ci s’explique par l’allongement des listes d’attente », relève Manuel Pascual. En tête du classement : le foie (12 importations en 2015, contre 33 en 2019). La Suisse possède en effet un accord privilégié avec la France en matière de greffe hépatique.
OFFRIR UNE FENÊTRE SUR LE MONDE
La greffe de cornée est la plus ancienne, la plus fréquente et la plus réussie des transplantations réalisées en Suisse. Elle souffre malgré tout de certains préjugés.
Les organes ne sont pas seuls à pouvoir être transplantés. Des tissus comme les valves cardiaques, les vaisseaux sanguins ou la cornée, ainsi que des cellules, peuvent également être donnés.
À l’Hôpital ophtalmique Jules-Gonin, 85 greffes de cornées, aussi appelées kératoplasties, sont effectuées en moyenne chaque année, permettant à des personnes malvoyantes ou aveugles de recouvrer une vision normale.
Hublot protecteur
La cornée est une fine membrane transparente située sur la surface de l’œil, juste devant l’iris (partie colorée). Épaisse d’un demi-millimètre, elle s’avère primordiale pour la transmission et la réfraction de la lumière. « À l’image du verre d’une montre, la cornée fait office de fenêtre », illustre GeorgiosKymionis , professeur à la Faculté de biologie et de médecine de l’UNIL et médecin chef à l’Hôpital ophtalmique Jules-Gonin.
Sous l’effet de maladies (par exemple la dystrophie de Fuchs) ou de traumatismes (coups, brûlures, etc.), la cornée peut perdre en transparence jusqu’à devenir totalement opaque, rendant les patients aveugles. Elle peut également se déformer, notamment en cas de kératocône. Le tissu prend alors progressivement la forme d’un cône. Une transplantation peut dès lors s’avérer nécessaire.
Spécialiste de la greffe de cornée, Georgios Kymionis souligne les progrès majeurs réalisés au cours des dix dernières années. « Par le passé, toute l’épaisseur de la membrane était transplantée. Nous réalisons désormais des greffes dites « lamellaires » ; seule la couche malade est remplacée. » Et comme la cornée ne contient pas de vaisseaux sanguins, nul besoin de trouver un donneur et un receveur compatibles, contrairement aux greffes d’organes. « Le taux de succès est de 95%. Pour prévenir un éventuel rejet (moins de 5%), les patients suivent un traitement léger, sous forme de gouttes à mettre dans les yeux. »
Devenir donneur jusqu’à 90 ans
Avec 937 transplantations effectuées en 2019*, la cornée figure en tête des greffes réalisées en Suisse. Pourtant, le nombre de dons ne suffit pas à répondre à la demande. « De plus, en raison de la pandémie de Covid-19, nous n’avons pu greffer aucun patient durant deux mois à Lausanne. Le temps d’attente s’est ainsi allongé, passant de six mois à un an », estime Georgios Kymionis.
Le médecin avance plusieurs pistes pour expliquer le manque de dons. « Certains s’excluent eux-mêmes, imaginant être trop âgés ou malades. Or, à quelques exceptions près, toute personne entre 16 et 90 ans peut donner sa cornée après son décès, même si elle souffre de myopie ou a subi une opération de la cataracte. »
Donner sa vision, non son regard
Parallèlement, l’opération suscite parfois des inquiétudes. Depuis le lancement du Registre national du don d’organes en octobre 2018, le don le plus souvent refusé est celui de la cornée. « 90% des 100’000 personnes inscrites acceptent le prélèvement de leurs organes. Seules 65% souhaitent léguer leurs cornées », indique le Dr Franz Immer, directeur de Swisstransplant. Accepter d’offrir ses yeux ou ceux d’un être cher peut s’avérer délicat. Considérés comme le miroir de l’âme, ils revêtent une dimension symbolique forte. Pourtant, le receveur n’hérite ni du regard, ni de la couleur des yeux de son donneur. « À Lausanne, nous prélevons uniquement la cornée, soit la fine couche transparente, insiste Georgios Kymionis. Le globe oculaire reste en place et le visage du défunt n’est pas modifié. »
Pour pallier la pénurie, des chercheurs américains ont développé des cornées artificielles ; des prothèses en plastique ressemblant à des lentilles de contact. À Lausanne, GeorgiosKymionis, en collaboration avec l’EPFL, teste actuellement la possibilité d’imprimer des cornées en 3D. « Mais le chemin à parcourir reste long, reconnaît le professeur. L’application à large échelle de ces technologies n’est pas pour tout de suite. Durant les cinq prochaines années, au minimum, notre activité continuera de se baser sur la générosité humaine. »
*Source : OFSP

Source: fbm



